编者按:
肿瘤分子分型:通过NGS、蛋白质组等组学技术,对肿瘤进行分子谱的系统描绘,并根据分子特征谱,进行肿瘤的精准分类及精准诊疗研究。
分子分型已成为国家精准医疗战略的重点研究投入方向;也备受CNS顶刊杂志青睐。
为了帮助广大临床研究者了解肿瘤分子分型及诊疗研究的重大前沿进展,我们收集整理了近几年来发表于Cell、Nature、Cancer Cell等顶刊上的,基于蛋白质组及蛋白基因组的肿瘤分子分型相关研究论文。
【肿瘤分子分型专辑】为大家精细解读重磅研究与进展。

【文献名称】:Proteomics identifies new therapeutic targets of early-stage hepatocellular carcinoma
【癌种】:肝癌
【细分癌种】:HBV感染的早期肝细胞癌
【人群】:中国大陆
【通讯单位】:国家蛋白质科学中心(北京)蛋白质组学国家重点实验室
【发表时间】:2019年
【涉及组学】:蛋白组、磷酸化修饰蛋白组
【文献出处】:DOI: 10.1038/s41586-019-0987-8
● 主要成果:
● 从蛋白质组水平定义了中国人群早期肝细胞癌的3种亚型(S-I、S-II和S-III),不同亚型的患者具有不同的临床结局
● SOAT1(甾醇O-酰基转移酶1)是S-III亚型的特征性表达分子,其通过调控胆固醇代谢参与肝癌细胞增殖和迁移,是潜在的药物治疗靶点
● SOAT1抑制剂—阿伐麦布(avasimibe)在 PDX模型上具有良好的靶向抗肿瘤效果
● 疾病背景:
【流行病学】:肝细胞癌是肿瘤致死的第三大因素。乙型肝炎病毒感染是肝细胞癌的主要风险因素之一,特别是在东亚地区。虽然手术治疗可能在早期阶段有效,但肿瘤进展后的五年总体存活率仅为50-70%。
【主要驱动基因】:p53、CTNNB1、KMT2C、AXIN1、ARID1A
● 研究设计:
【主要样本】:HBV感染的早期肝细胞癌((Barcelona Clinic Liver Cancer stages 0 and A),经手术切除的癌 VS 非癌组织
【样本状态】:新鲜冰冻
【样本数量】:110 paired
【主要研究路线与内容】:
1.单组学分析:
组别:癌组织 VS 非癌组织
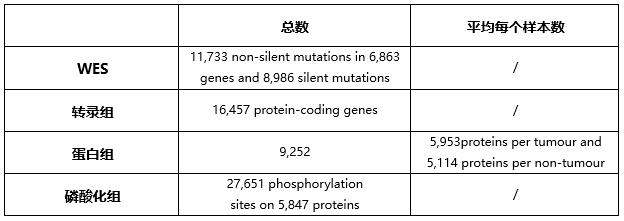
WES:基因拷贝数、基因突变;
转录组:mRNA表达
Label free蛋白组:蛋白鉴定与定量数量;
Label free磷酸化蛋白组:修饰蛋白、修饰肽段鉴定与定量数量
2. 整合分析:

● 主要研究结果:
一、多种学检测结果的统计:
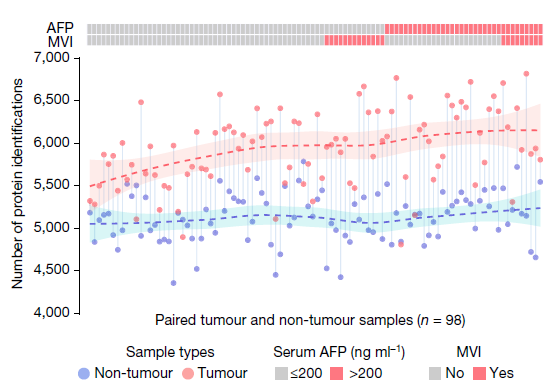
二、早期肝细胞癌的蛋白组表达特征
在检测到的蛋白质数量水平上,不同人群的肿瘤与非肿瘤组织具有显著差异:
(1)肿瘤组织显著高于非肿瘤组织
(2)hign AFP肿瘤病人大于高于low AFP肿瘤病人
(3)微血管入侵阳性 (MVI+)肿瘤病人普遍高于微血管入侵阴性(MVI-)肿瘤病人
三、 基于蛋白质组的分子分型与预后
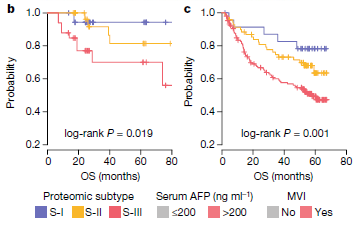
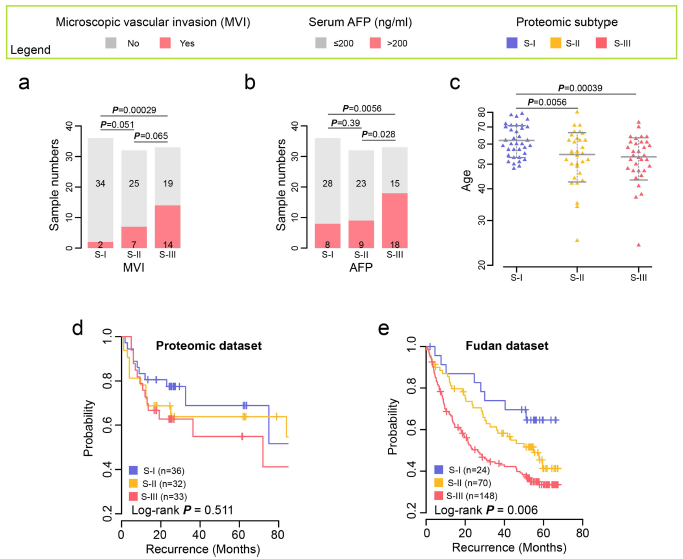
1. 蛋白质组分型:根据101例癌组织样本的蛋白质组数据,将目前临床上认为的早期肝细胞癌患者,分成三种亚型:S-I(36例),S-II(32例)和S-III(33例)。不同亚型具有不同的功能紊乱特征。
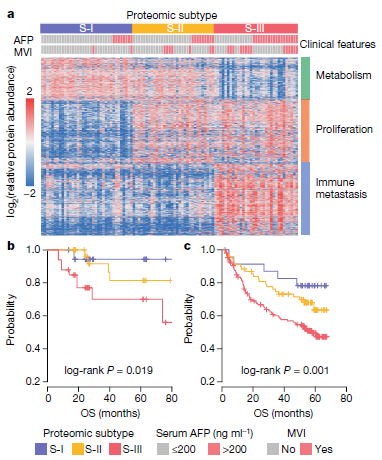
2. 亚型的临床预后特:不同亚型的患者具有不同的生存预后。亚型的预后差异进一步在外部队列(复旦队列)中进行了验证。
四、S-III亚型的预后与分子特征:
1. S-III型具有最差的预后:包括更高程度的MVI+和high AFP,更年轻;更低的整体生存期;更高的术后死亡率;更高的复发率。
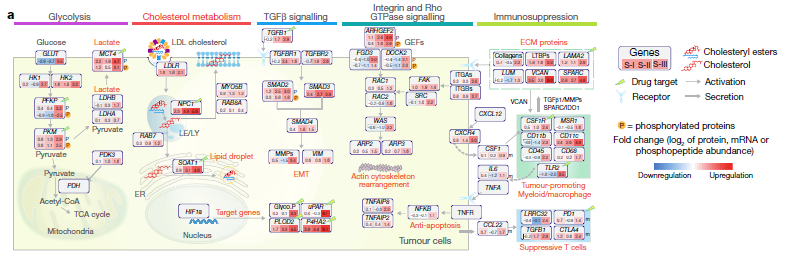
2. S-III具有更具侵略性的分子特征:包括与预后不良相关的蛋白质(如TGFβ1,KRT19和MMP9)的上调和肿瘤促进途径的激活(例如TGFβ, HIF1, integrin 和 Rho GTPases)。相比之下,S-I和S-II亚型则具有较低的侵略性特征,包括Hoshida S38、WNT和CTNNB1激活相关等。
五、 S-III亚型的药靶发现:SOAT1
S-III亚型的患者手术后预后最差,应接受进一步的靶向治疗。针对该亚型的特征表达蛋白,尤其是已经由FDA批准或临床试验中的候选药物,很可能成为该亚型的潜在治疗靶点。在众多潜在靶点中,SOAT1(能够催化脂肪酸 - 胆固醇酯的形成)可能是有益的潜在靶点:
1. SOAT1的表达特征:SOAT1在肿瘤组织中的表达显著高于临近非肿瘤组织(包括其他胆固醇代谢稳态相关蛋白也具有类似的表达特征);且SOAT1在S-III亚型中的表达显著高于S-I和S-II亚型,具有亚型表达特异性。
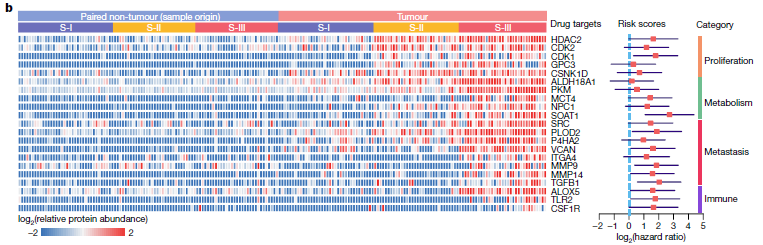
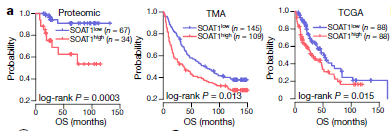
2. SOAT1的预后相关:SOAT1具有最高的预后风险得分(见上图)。在蛋白质组队列、TMA队列及TCGA中,SOAT1的表达水平与整体存活率显著相关,并且是独立的的预后因子。在其他类型肿瘤中的报道中,也有类似数据显示。
3. SOAT1的肿瘤生物学功能:为了证实SOAT1的功能,将SOAT1在HCC cell lines中进行敲除:
(1)肿瘤细胞的增殖和迁移:被抑制
(2)HCC增殖、迁移相关蛋白(ITGAV, ITGAL, ITGA6, ITGB4 and TGFβR1)在细胞膜上的表达:被抑制
(3)细胞膜的胆固醇水平,以及胆固醇转运相关蛋白的表达水平(SREBF2, LDLR, RAB8A and MYO5B):被抑制

六、 药效验证:SOAT1抑制剂阿伐麦布
1. 细胞水平:阿伐麦布处理肝癌细胞系,表现出与SOAT1敲除相同的作用。包括能够抑制细胞的增殖和迁移,抑制HCC增殖、迁移相关蛋白在细胞膜上的表达;抑制细胞膜的胆固醇水平,以及胆固醇转运相关蛋白的表达
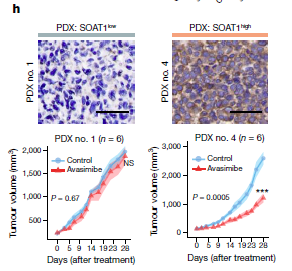
2. PDX动物模型水平:采用6对PDX模型评价药效,阿伐麦布给药不影响动物体重,对SOAT1低表达肿瘤无效,但可显著抑制SOAT1高表达肿瘤的生长,说明阿伐麦布具有靶向治疗S-III亚型的潜力。
● 总结:
该研究系统性分析了110例中国人群队列的HBV感染的早期肝细胞癌患者的肿瘤及配对的非肿瘤组织的基因组、转录组、蛋白质组和磷酸化蛋白质组。首次对早期肝细胞癌进行了蛋白质组水平上的分子分型。其中,S-III亚型的一线手术治疗不良预后风险最高,具有最低的整体生存期,其典型病理分子特征是胆固醇代谢紊乱。该研究进一步基于该亚型的蛋白表达的特征,发现SOAT1(甾醇O-酰基转移酶1)是S-III亚型的潜在治疗靶点,且SOAT1抑制剂阿伐麦布(曾进行过动脉粥样硬化治疗的临床试验)在PDX模型中表现出良好的肿瘤靶向治疗效果。该研究提供了基于蛋白功能水平进行肿瘤分子分型,及药靶与药物发现的典型范式。