前言
细胞是生命活动的基本单元。对细胞的精确认知是理解细胞在生理和病理过程中功能的先决条件。
在组织、器官或个体中,细胞具有非常大的异质性,而传统的研究手段针对大量细胞进行分析,得到的是大量细胞的平均结果,无法区分不同细胞个体对于大量样品结果的具体贡献值,从而忽视或掩盖了单细胞的个体差异,不能完全捕捉细胞的复杂性、多样性以及功能的不同。
因此非常有必要开发新技术在单细胞水平揭示细胞异质性,目前对单细胞技术的需求越来越高。
PART01
二代测序技术的持续发展使对单细胞基因组和转录组的研究突飞猛进,科学家们对细胞认识的分辨率大大提高,然而单细胞的基因组和转录组数据对描述细胞在生物体复杂环境中的表型和功能还远远不够,而蛋白质作为细胞内所有功能的直接执行者,细胞通过蛋白质及其翻译后修饰,可以感知并响应几乎所有外在和内在的刺激,从而影响整个生命体的功能和状态。
因此,对单细胞蛋白质组的定性和定量分析,是揭示细胞类型及其状态的必不可少工具,在肿瘤异质性、干细胞分化、生殖细胞发育、循环肿瘤细胞等重要领域有着不可或缺的应用价值。
单细胞蛋白质组学的目的就是为了实现对单个细胞内蛋白质组成的定性和定量分析,从而获得不同细胞个体蛋白组的定性和定量差异,构建精细蛋白分子图谱,从根本上揭示不同细胞个体之间的类型及其状态的差异,使科研工作者可以更好地了解细胞及其表型和生命活动。
PART02
单细胞蛋白质组学技术的难点和瓶颈主要在于单细胞内极其微量的蛋白质,一般单个细胞内的蛋白质总量仅不到200 pg,而其又是由上万种不同种类的蛋白质组成,这些蛋白质以极高的动态范围、不同的拷贝数存在于一个单独的细胞中。
直接对这些蛋白质进行组学鉴定分析,在其样品前处理、分离和质谱检测都是一种挑战。因此受到极微量样本制备、超高灵敏度高分辨生物质谱仪等限制,单细胞蛋白质组学分析一直都是“圣杯”一样存在。
PART03
目前为解决单细胞极微量样本制备的难点,科学家们开发出来一种体系是基于TMT进行标记的方法,如scope2。
Scope2研究系统主要是通过TMT的多通道优势,将其中一个通道作为carrier cell通道,一般为20~200个细胞量的样品,其他通道作为单细胞通道。各通道在完成TMT标记后进行混合上机检测。
采用carrier cell通道的优点有如下几点,第一、可以有效补偿单细胞样品在后续分析中的损失;第二、其对蛋白质的定性可以使用含量更高的carrier cell通道中的MS/MS,而借助TMT各通道报告离子进行定量;第三、大大提高单细胞检测的通量。
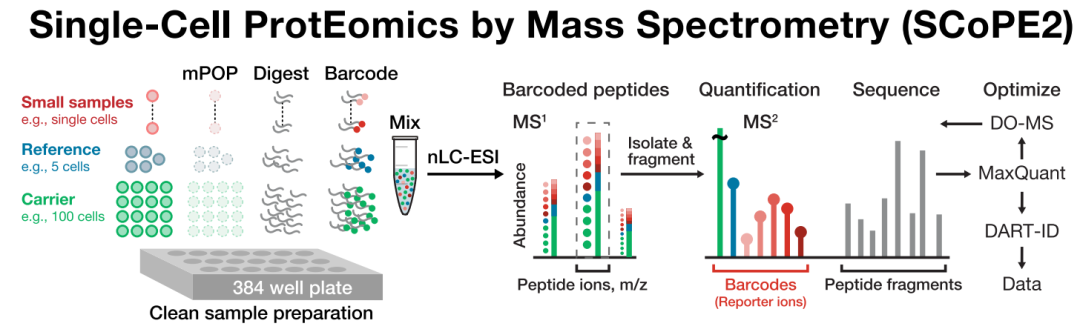
基于scope2技术的单细胞蛋白质组学分析流程
https://doi: 10.1186/s13059-021-02267-5
除此之外,还有研究者采用基于液滴的样品前处理系统,如nanoPOTS、gOAD、nested nanoPOTS(N2) chip和proteoCHIP系统,这类系统主要优点有:1)液滴体积小可以减少与管壁接触转移带来的样品损失问题;2)小体积液滴与单细胞样品兼容性更好,具有更高的酶切反应速率。但也有其不足之处,比如该液滴操作系统需要在具备相关操作能力的实验室开展,还需开发适用于液滴体系上样的新技术。

基于液滴体系的样品前处理和离心处理上样系统proteoCHIP的工作流程
https://doi.org/10.1101/2021.02.17.431689
其中在N2 chip和proteoCHIP系统中结合了微流控液滴和TMT标记的技术,可进一步提高单细胞分析的检测通量和定量蛋白质数目。
此外,还有一类是结合超高灵敏度质谱仪timsTOF和DIA采集模式,在前处理过程中缩小反应体系到2ul左右以此减少样品损失,实现单细胞的蛋白质组学分析。
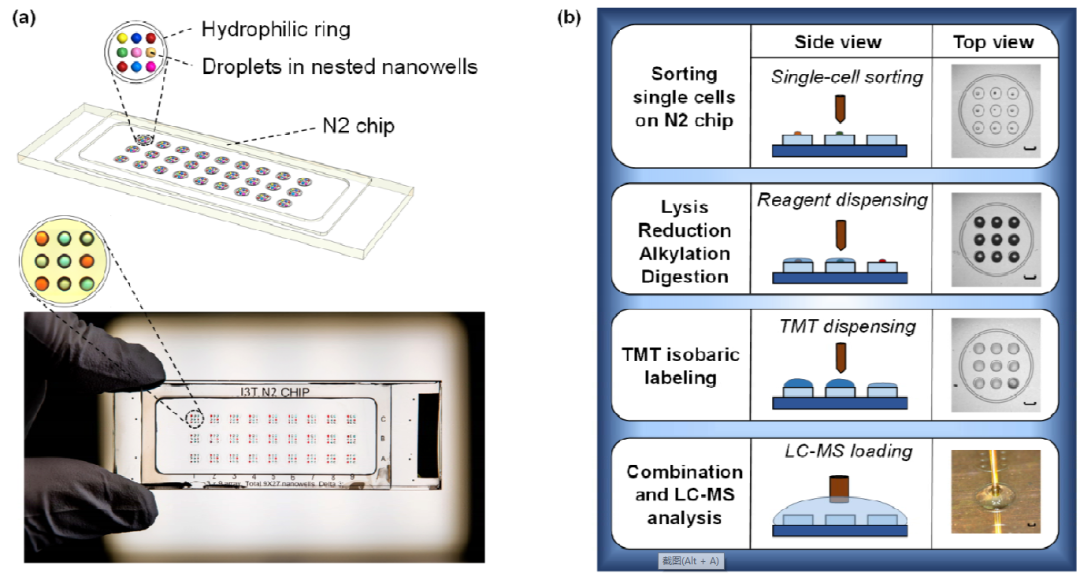
基于液滴体系的样品前处理和液滴自动进样器的N2系统工作流程
https://doi.org/10.1101/2021.04.14.439828

基于Evosep和timsTOF-DIA联用的单细胞样品前处理系统
https://doi.org/10.1101/2020.12.22.423933
PART04
通过单细胞蛋白质组学分析可以根据差异蛋白质信息来区分不同肿瘤细胞的分子分型,相较于传统的病理组织分析技术更加精细准确,对于理解疾病的发生发展具有重要的意义。
另外,一些生物学样品由于稀少,单细胞技术是唯一可以对其进行研究的技术。例如在胚胎发育早期阶段少量个数的细胞、在神经生物学领域越来越得到重视的单个神经元以及数量稀少的循环肿瘤细胞等,传统蛋白组学技术无法获得这类样品的蛋白质组学数据,因此单细胞蛋白质组将是必要的手段,对于组织亚结构研究、胚胎发育、肿瘤异质性、CTC细胞、干细胞分化和神经研究提供重要的生物学意义。
