PNAS (IF=9.1)|天津医科大学张锴团队锁定组蛋白乳酸化“阅读器”,揭开宫颈癌进展新机制!

文章标题:DPF2 reads histone lactylation to drive transcription and tumorigenesis
中文标题:DPF2通过识别组蛋白乳酸化驱动转录与肿瘤发生
发表期刊:PNAS
影响因子:9.1
文章简介
天津医科大学张锴教授课题组在PNAS期刊发表了题为“DPF2 reads histone lactylation to drive transcription and tumorigenesis”的研究。这项研究鉴定出DPF2是组蛋白乳酸化修饰的特异性“阅读器”,阐明其通过识别H3K14la调控癌基因转录、推动宫颈癌进展的分子机制,为代谢-表观遗传交叉领域及宫颈癌治疗提供全新靶点!
研究背景
组蛋白翻译后修饰(hPTMs)是表观遗传调控的核心环节,而近年发现的组蛋白乳酸化(Kla) ,更是打通了“细胞代谢”与“基因表达”的关键通路——癌细胞因瓦伯格效应产生的大量乳酸,可转化为组蛋白乳酸化的“原料”,进而影响肿瘤进展。但长期以来,组蛋白乳酸化的特异性“阅读器”始终未被发现,成为制约乳酸化调控机制研究的“瓶颈”。张锴团队此前开发的“自组装多价光亲和探针”技术,为捕获这类瞬时结合的“阅读器”提供了突破口——该研究正是基于该技术,针对宫颈癌中关键的H3K14la修饰展开探索。
研究结果
3.1 组蛋白乳酸化与细胞增殖及肿瘤发生相关
癌细胞即使在有氧条件下也常保持活跃糖酵解,经乳酸脱氢酶(LDH)催化生成大量乳酸,而乳酸可促进组蛋白乳酸化,但该修饰在宫颈癌中的作用尚不明确,故推测高LDH可能通过增加乳酸、升高组蛋白乳酸化介导宫颈癌发生。为验证此推测,基因分析发现LDH在宫颈癌(含宫颈鳞癌/腺癌)及其他子宫癌中显著上调,糖酵解关键酶PKM也高表达,且高LDH与患者短生存期相关,LDH抑制剂则能抑制癌细胞增殖,表明乳酸升高或与宫颈癌发生相关(图1A-C)。进一步蛋白印迹分析显示乳酸存在时组蛋白泛乳酸化显著升高,从HeLa细胞中还鉴定出组蛋白乳酸化供体“乳酸辅酶A”,且LC-MS/MS检测到HeLa细胞中H3K14la存在、乳酸预处理可提升其比例(图1D-E)。综上,乳酸是组蛋白乳酸化的直接决定因素,H3K14la等组蛋白乳酸化升高或参与宫颈癌发生进展。
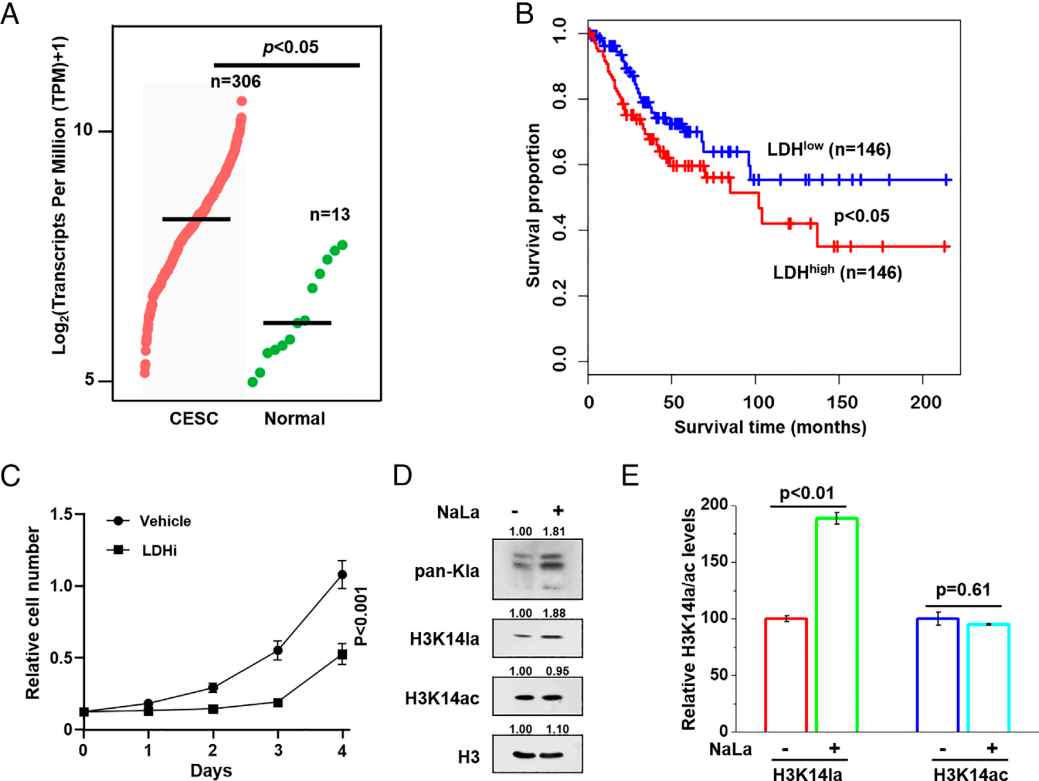
图1. 组蛋白乳酸化与细胞增殖及肿瘤发生相关
3.2 化学蛋白质组学方法鉴定DPF2为H3K14la的靶蛋白
组蛋白翻译后修饰(hPTMs)可通过招募结合蛋白传递信号,据此推测H3K14la可能通过结合蛋白调控基因转录与肿瘤发生,且多价光亲和探针结合定量蛋白质组学的策略,有助于解析其靶蛋白。该研究参照前期方法,构建了含多价乳酸化肽段、经光交联剂连接PEG的H3K14la探针,还制备了仅将Kla替换为未修饰K的H3K14对照探针(图2A)。随后用两种探针分别与核提取物孵育,经紫外线光交联、清洗去除非特异性结合蛋白、分离标记蛋白后,通过磁珠酶解及定量LC-MS/MS筛选出170个相对于对照显著富集的H3K14la候选结合蛋白(图2B);GO分析显示这些蛋白多参与RNA结合、转录调控等功能(图2C),且鉴定出组蛋白乳酸化修饰酶KAT5与去修饰酶HDAC3,其中与癌症相关、可识别组蛋白乙酰化/巴豆酰化的BAF复合物亚基DPF2被确定为潜在结合蛋白,推测其可能通过识别H3K14la介导癌症中的转录与表观遗传调控。
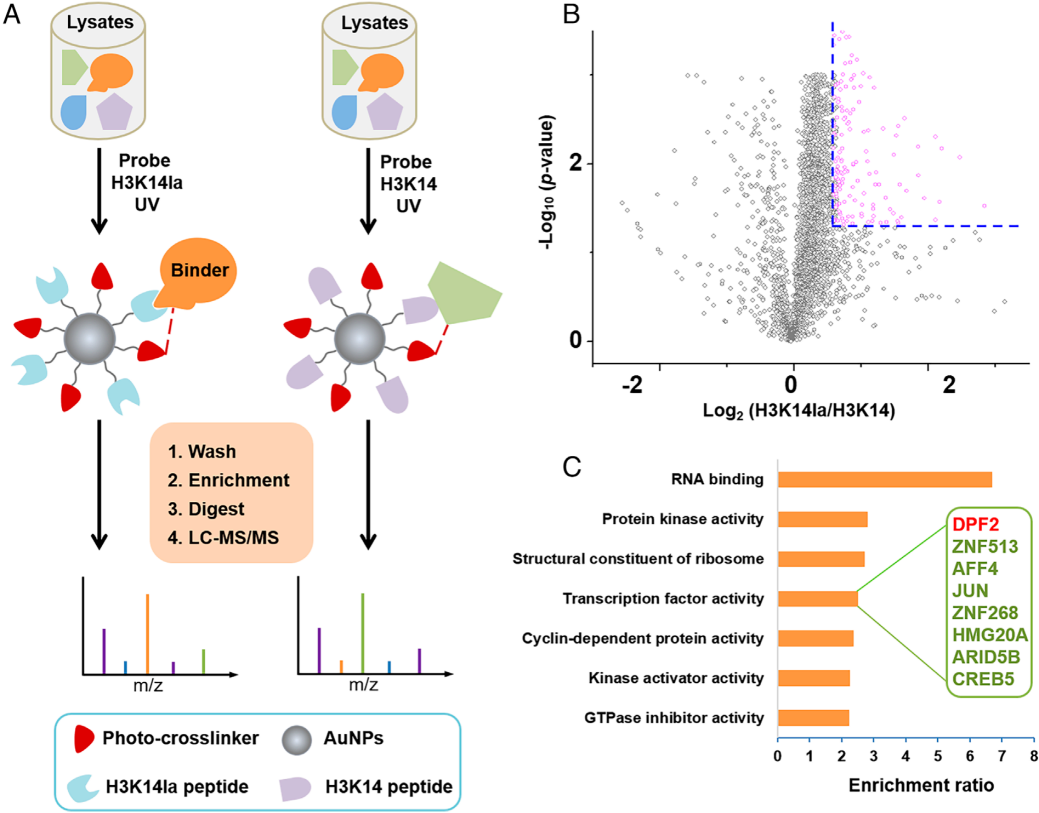
图2. 使用多价光亲和探针鉴定DPF2为H3K14la靶蛋白
3.3 DPF2在体外通过其DPF结构域结合H3K14la
已知DPF2的DPF结构域可结合组蛋白乙酰化,研究遂探究其是否直接结合H3K14la。重组表达DPF2的DPF结构域(DPF2DPF)后,ITC实验显示,其与H3K14la肽段的结合解离常数(Kd)为0.60 μM,与H3K14ac(H3K14乙酰化)肽段的Kd为0.65 μM,而与未修饰H3K14肽段的Kd>100 μM(图3A);进一步检测DPF1、DPF3的DPF结构域,发现二者与H3K14la的结合亲和力几乎完全丧失(图3B),表明DPF2可通过DPF结构域在体外直接且高效结合H3K14la。
为解析相互作用机制,将DPF2DPF(PDB:5B79)与H3K14la肽段进行分子对接分析,发现DPF2DPF以类似识别Kac的模式识别Kla,H3的N端α-螺旋通过静电作用和氢键与PHD2结合,Kla锚定于PHD1的疏水口袋,且Kla的乳酸酰胺基团嵌入D274、F275等残基构成的“笼状结构”,其羟基通过两个直接氢键与D274相互作用(图3C-E);后续定点突变实验(将D274、R300、D346突变为丙氨酸)显示,所有突变体与H3K14la的结合亲和力均较野生型显著下降,证实DPF2通过DPF结构域,借助D274等关键残基识别H3K14la。
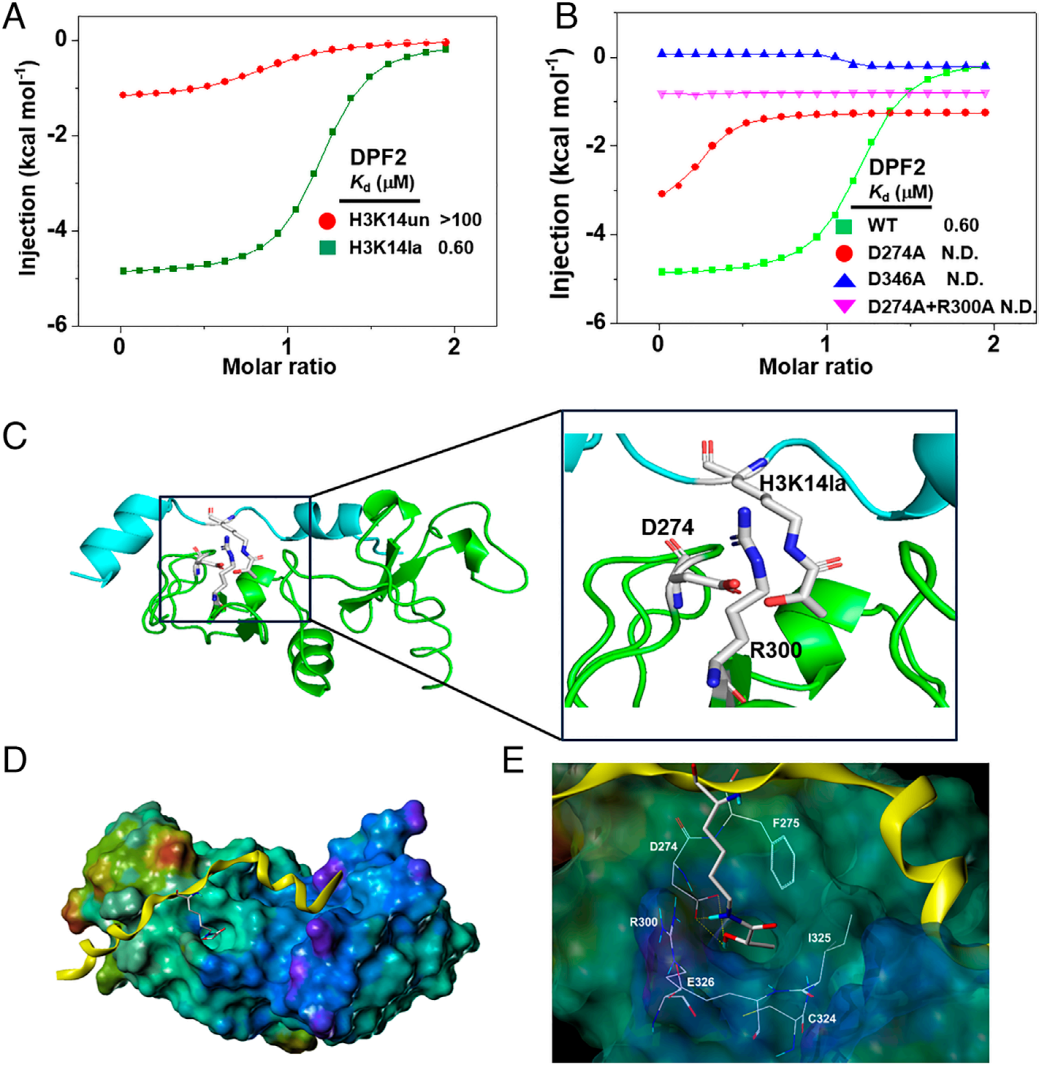
图3. DPF2在体外通过其DPF结构域结合H3K14la
3.4 DPF2在细胞内与H3K14la存在关联
为验证细胞内DPF2与H3K14la的关联,该研究在HeLa细胞中分别过表达Flag 标签标记的野生型DPF2(WT-DPF2)及两种突变体(DPF2-D274A、DPF2-D274A-R300A),并通过基于Flag-DPF2的下拉实验探究二者相互作用(图4A)。实验提取细胞染色质后,用抗Flag抗体磁珠进行免疫沉淀(IP),后续蛋白质印迹分析显示:野生型DPF2能捕获乳酸化修饰的组蛋白H3,而突变体无法捕获,证实细胞内DPF2与H3K14la存在关联(图4B)。
进一步通过免疫荧光(IF)实验评估共定位情况:将转染WT-DPF2或突变体的细胞与抗Flag(检测DPF2)、抗H3K14la(检测乳酸化组蛋白)抗体孵育,结果显示WT-DPF2与H3K14la的信号重叠度高,皮尔逊相关系数达0.77,证实二者共定位;而DPF2突变体与H3K14la的皮尔逊相关系数显著降低,表明突变破坏了二者共定位关系(图4C-D)。综上,这些结果提示细胞内DPF2与H3K14la存在关联。
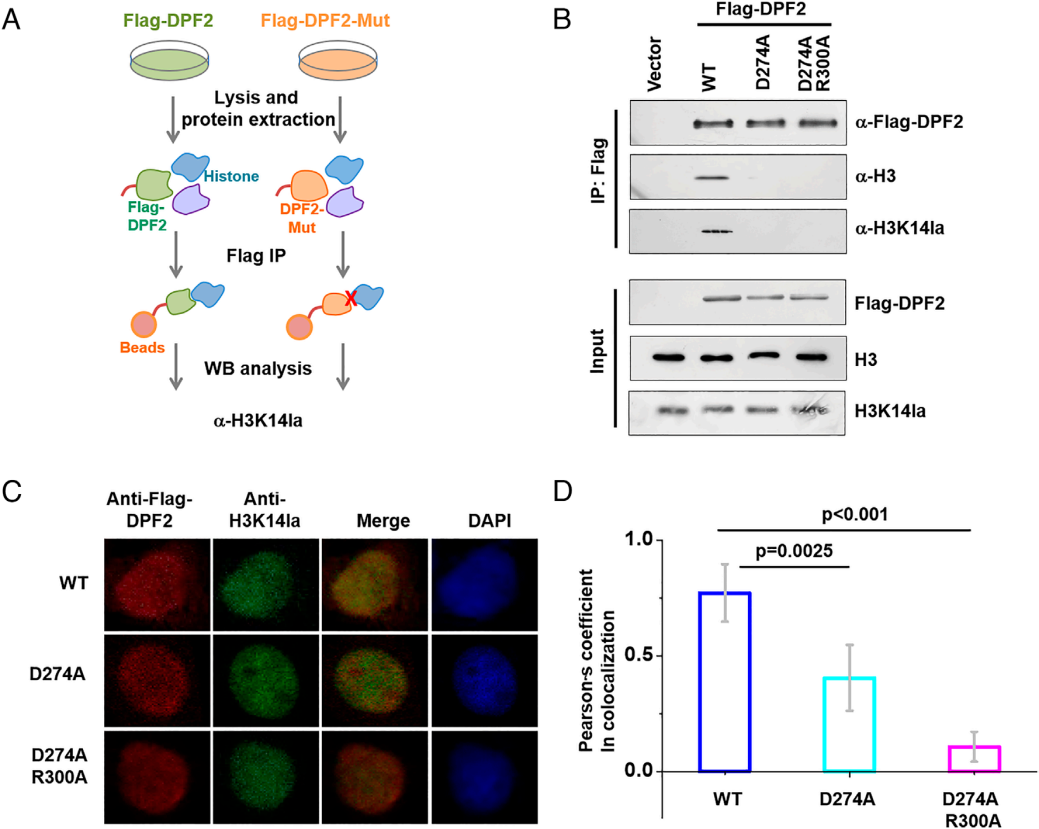
图4. DPF2在细胞内与H3K14la存在关联
3.5 DPF2与H3K14la在全基因组范围内共定位并介导基因转录
为验证DPF2在天然染色质上与H3K14la的结合,研究在乳酸预处理的HeLa细胞中开展CUT&Tag实验:对稳定表达Flag-DPF2的细胞用抗Flag或抗H3K14la抗体免疫沉淀后高通量测序,鉴定出1803个H3K14la富集峰和9747个DPF2结合峰,其中1037个基因为二者共占(图5A-C);GO分析显示这些重叠基因参与细胞增殖、迁移,与H3K14ac-DPF2共定位基因功能差异显著,提示H3K14la沉积基因具特异性(图5D),且Flag-BAF47的CUT&Tag实验证实DPF2识别H3K14la依赖BAF复合物(图5E)。
后续探究DPF结构域作用:稳定表达突变型DPF2(Mut-DPF2)的细胞CUT&Tag结果显示,其启动子区域结合丰度较野生型(WT-DPF2)显著降低,靶基因(如SEMA5A)信号减弱(图5F),表明DPF结构域对DPF2结合染色质至关重要;对乳酸预处理后表达WT/Mut-DPF2的细胞做RNA-Seq,发现DPF2突变导致600余个基因下调(多与细胞存活相关,癌基因表达受抑),且乳酸(而非乙酸)预处理仅升高H3K14la并促进转录,证实H3K14la介导基因激活(图5G)。综上,DPF2可能通过DPF结构域识别启动子区H3K14la,进而介导基因转录。
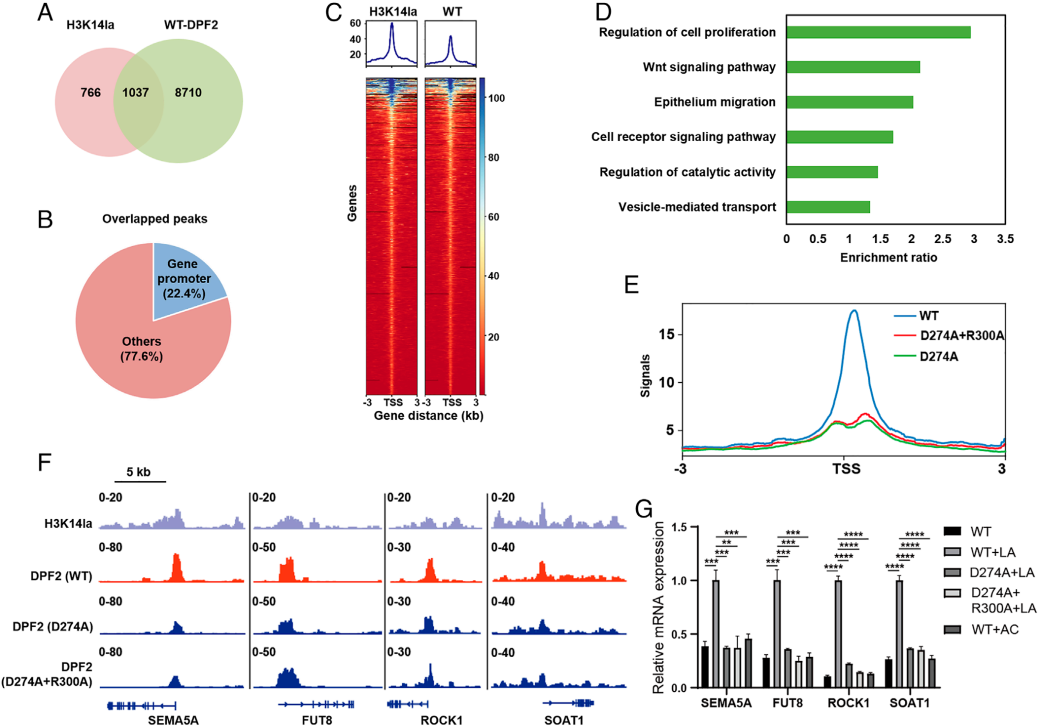
图5. DPF2与H3K14la在全基因组范围内共定位,并介导基因转录
3.6 DPF2将组蛋白乳酸化与细胞存活关联起来
基于此前发现“DPF2通过与H3K14la相互作用调控癌相关基因转录”,该研究进一步探究该关联对癌细胞生长存活的影响:在乳酸喂养条件下进行CCK-8和集落形成实验。结果显示,即使有乳酸存在,敲低DPF2仍会显著降低细胞增殖与集落形成能力,提示H3K14la的功能可能主要依赖与DPF2的结合;而异位表达野生型DPF2(WT-DPF2)可恢复上述能力,其突变体(Mut-DPF2)则无法恢复(图6A-D)。
综上,H3K14la通过结合DPF2促进癌相关基因表达,进而推动癌细胞生长存活。研究提出调控模型:DPF2识别组蛋白乳酸化并结合于靶基因启动子,招募转录机器驱动癌基因表达与肿瘤细胞增殖;而通过DPF结构域突变破坏二者相互作用,或限制LDH活性降低组蛋白乳酸化水平,均可削弱细胞存活能力(图 6E)。
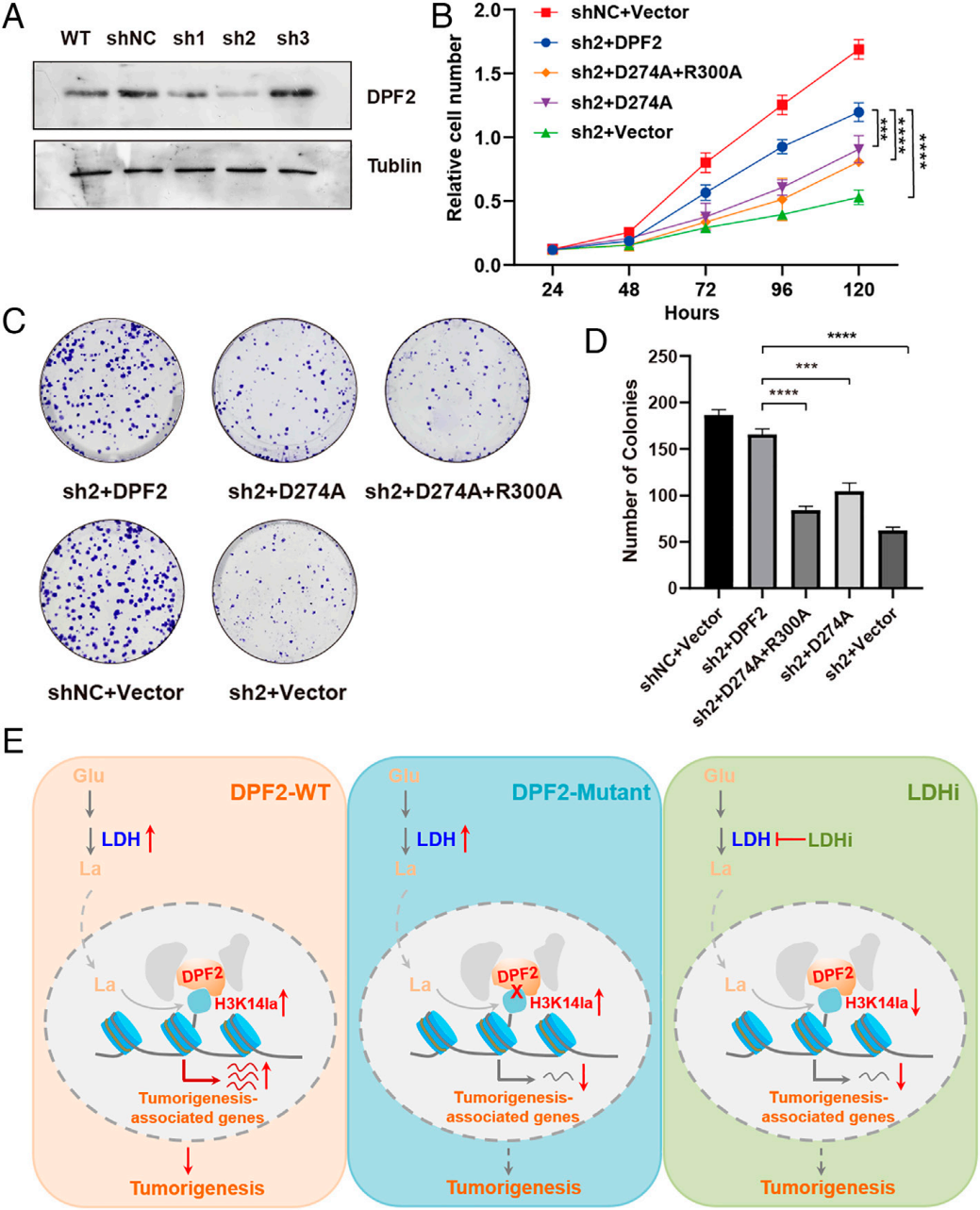
图6. DPF2将组蛋白乳酸化与细胞存活关联起来
研究小结
这项研究不仅首次鉴定出组蛋白乳酸化的特异性“阅读器”DPF2,更构建了“乳酸代谢→H3K14la修饰→DPF2结合→癌基因激活→宫颈癌进展”的完整调控链,为理解代谢异常如何通过表观遗传驱动肿瘤提供了全新范式。
在治疗层面,靶向DPF2的D274残基(破坏其与H3K14la结合),或抑制LDH降低H3K14la水平,有望成为宫颈癌精准治疗的新策略——为后续药物研发提供了明确靶点!
全景修饰蛋白质组学:作为一种蛋白质翻译后修饰(PTM)研究技术,仅需一份生物样本,即可实现对样本中的多种蛋白质修饰类型进行鉴定与定量分析,能够一次性精准鉴定数千种蛋白质上的上万个修饰位点,有效规避了传统方法因单次仅关注一种修饰类型而导致的大量关键修饰信息遗漏问题。百趣生物推出的全景修饰蛋白质组学技术,目前已实现对多种重要蛋白质翻译后修饰类型的覆盖,包括磷酸化、乙酰化、乳酸化、泛素化、琥珀酰化等。从生物学功能层面来看,这些翻译后修饰可通过改变蛋白质的理化性质、空间构象及活性状态,在细胞信号传导通路调控、物质代谢网络平衡、疾病发生发展的分子机制等核心生理病理过程中发挥不可替代的关键调控作用。
百趣生物提供“全景修饰蛋白质组学”等专业技术服务,助您快速解锁研究瓶颈。
END
hao 撰文
SY 校稿